30 NEURONES CONTRE LA DOULEUR
Dans le cerveau, une toute petite population de neurones coordonne les différentes étapes d’un processus qui atténue les douleurs de type inflammatoire.
Atténuation de la douleur, contraction de l’utérus lors de l’accouchement, lactation, attachement de l’enfant à sa mère, orgasme, régulation du comportement social, de l’anxiété, de l’empathie… Une molécule, l’ocytocine, produit à elle seule tous ces effets. Or sur les quelque 90 milliards de neurones que compte notre cerveau, seule une petite population de 40 000 à 60 000 neurones située au cœur de l’hypothalamus sécrète ce messager. Libérée dans le sang ou directement dans le cerveau, l’ocytocine cible les neurones périphériques, les cellules musculaires de l’utérus, les glandes mammaires ou le cerveau antérieur en fonction des signaux qui ont déclenché son émission. Comment un si petit centre induit-il une telle palette d’actions ?
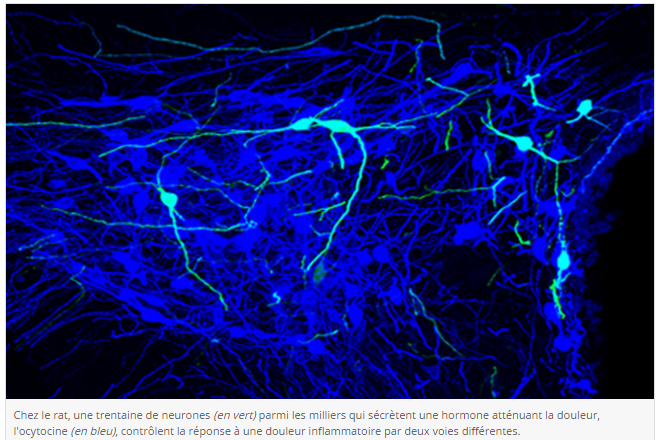
Selon une hypothèse envisagée depuis quelques années, au sein de ce centre ocytocinergique, de petites sous-populations de neurones assureraient chacune un rôle. Mais ces sous-populations n’avaient pas encore été mises en évidence… jusqu’à aujourd’hui. Une équipe internationale coordonnée en France par Alexandre Charlet, de l’Institut des neurosciences cellulaires et intégratives (CNRS/université de Strasbourg), a montré que, chez le rat, une trentaine de neurones du centre ocytocinergique contrôlent la réponse à un certain type de douleur, les douleurs inflammatoires.
Les neurobiologistes voulaient cartographier le centre ocytocinergique afin de mieux comprendre comment il dialogue avec ses différentes cibles, notamment le cerveau antérieur. En effet, l’ocytocine est produite par deux types de neurones : les neurones magnocellulaires, de gros neurones qui projettent leur axone vers le système sanguin et le cerveau antérieur, et les neurones parvocellulaires, de petits neurones dont l’axone rejoint d’autres régions du tronc cérébral et de la moelle épinière. Dans l’hypothalamus, ces deux types de neurones cohabitent, certains produisant de l’ocytocine, d’autres non, et l’ensemble forme un écheveau complexe que les chercheurs démêlent.
Alexandre Charlet et ses collègues ont commencé par étudier la neuroanatomie du système ocytocinergique du rat, très proche de celui de l’homme. Ils se sont ainsi aperçus que dans une région de l’hypothalamus, le noyau paraventriculaire, une trentaine de neurones parvocellulaires ocytocinergiques projetaient deux axones les reliant l’un vers des neurones magnocellulaires d’une autre région de l’hypothalamus, les deux noyaux supraoptiques, l’autre vers les couches profondes de la moelle épinière.
Or les couches profondes de la moelle épinière sont le lieu où, lors d’une douleur, le message sensoriel provenant des nerfs touchés est interprété et codé en une information qui rejoint d’autres neurones, dont le centre ocytocinergique. Ce dernier libère alors de l’ocytocine dans le sang, qui atteint ainsi les nerfs touchés et diminue les signaux de douleur émis.
Les neurobiologistes ont donc regardé si la trentaine de neurones jouaient un rôle dans la modulation de la douleur. D’abord, ils ont montré que ceux-ci communiquent bien avec leurs deux populations cibles dans la moelle épinière et les noyaux supraoptiques.
La technique utilisée ressemble à l’assemblage d’un puzzle. Ils ont mis au point à l’aide de virus modifiés une approche qui leur permet de ne déclencher l’expression d’une protéine fluorescente dans les trente neurones que s’il y a communication avec la population cible : chacune de ces deux populations porte un virus contenant un élément du puzzle nécessaire à l’expression de la protéine. La protéine fluorescente a bien été produite dans les trente neurones.
Ensuite, ils ont vérifié chez le rat que chaque voie était bien fonctionnelle en stimulant les trente neurones et en suivant les réponses sur chacune des voies. Enfin, ils ont observé qu’en activant ou inhibant les trente neurones, ils modulaient la réponse de l’animal à une douleur inflammatoire, mais pas à une douleur neuropathique.
En libérant de l’ocytocine dans deux endroits simultanément, la petite population de neurones contrôle donc de deux façons l’atténuation de la perception de la douleur. D’une part elle active des neurones magnocellulaires d’une autre région de l’hypothalamus, qui libèrent à leur tour de l’ocytocine dans le sang ; d’autre part, elle module directement dans la moelle épinière le message de douleur codé et envoyé notamment au centre ocytocinergique, comme une sorte de boucle de rétroaction négative.
« Cette découverte fondamentale n’offre que des opportunités lointaines et théoriques pour le traitement des douleurs » , commente Alexandre Charlet. « Notre travail est avant tout un travail de recherche fondamentale visant à mieux comprendre la modulation sélective des émotions. On connaissait déjà le rôle analgésique de l’ocytocine et le mécanisme global qui déclenche sa production. Mais pour la première fois, on décrit une population de neurones ayant à la fois un effet central et un effet périphérique : son action coordonne à elle seule les sécrétions centrale et périphérique de l’ocytocine. »
Ce n’est d’ailleurs probablement pas sa seule fonction. Alexandre Charlet et ses collègues étudient son implication dans d’autres processus, tels que la lactation et certains comportements sexuels. Ses neurones cibles dans la moelle épinière font en effet partie du système nerveux autonome, impliqué dans ces processus. L’équipe continue aussi l’exploration du centre ocytocinergique. Les objectifs : déterminer les circuits qui modulent les émotions et préciser le mode d’action de l’ocytocine au niveau du cerveau antérieur.
SOURCE : Pour la Science 09.03.2016
A découvrir aussi
- UNE INTELLIGENCE ARTIFICIELLE DE GOOGLE CAPABLE DE DISCUTER DU SENS DE LA VIE
- POURQUOI CONSTRUIRE DES ROBOTS HUMANOÏDES ?
- LE NOUVEAU PROJET DES GÉANTS DE LA TECHNOLOGIE : DÉFIER LA MORT
Retour aux articles de la catégorie DIVERS SCIENCE -
⨯
Inscrivez-vous au blog
Soyez prévenu par email des prochaines mises à jour
Rejoignez les 202 autres membres